2015年《食品安全法》的发布实施,标志着保健食品注册与备案双轨制运行的正式启动。2016年发布的《保健食品原料目录(一)》正式启动了维生素矿物质类产品的备案工作。2021年《辅酶Q10等五种保健食品原料备案产品剂型及技术要求》、《保健食品备案可用辅料及其使用规定(2021年版)》《保健食品备案产品剂型及技术要求(2021年版)》的连续发布更是让业界看到了国家积极推进双轨制的决心。针对相关新出台的文件,如何备案,应该注意哪些问题,本文将为您一一解析。
01
备案主体有哪些?
国产保健食品
国产保健食品备案人应当是保健食品生产企业。保健食品原注册人(以下简称原注册人)可以作为备案人。
进口保健食品
进口保健食品备案人应当是上市保健食品境外生产厂商。境外生产厂商(备案人)是指符合其所在国(地区)上市要求的法人或其他组织。产品生产国(地区)是指进口保健食品上市销售的国家(地区)。
02
填报流程是怎样的?
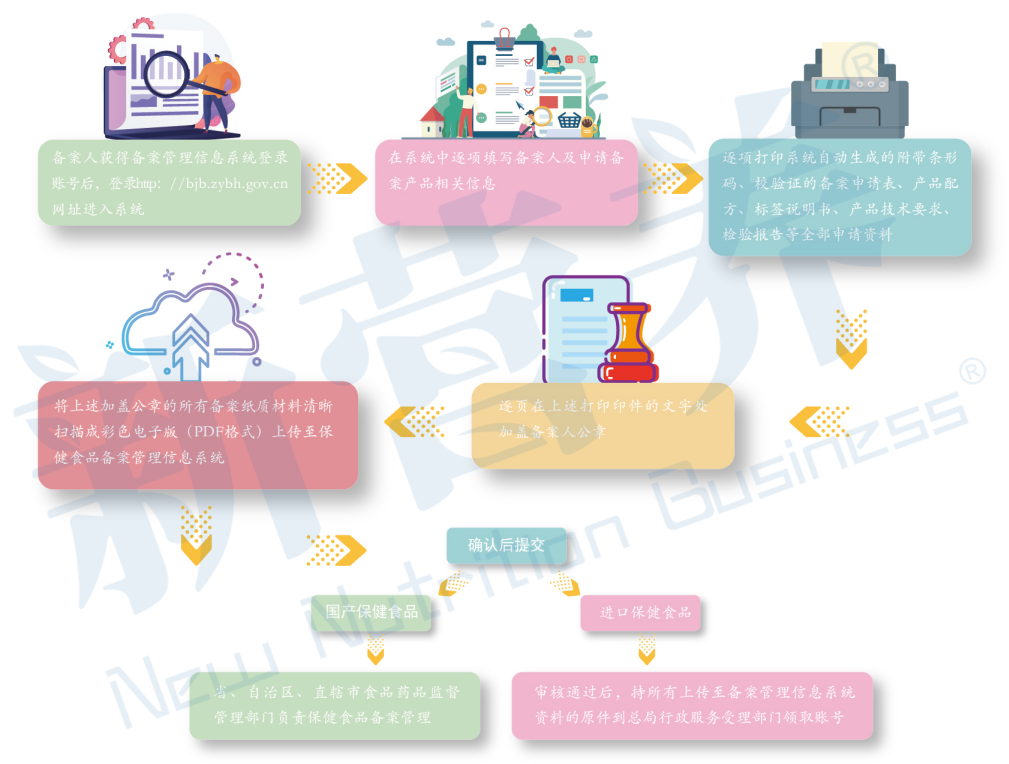
03
哪些原料可以用于备案?
营养素补充剂
根据《中华人民共和国食品安全法》、《保健食品原料目录与保健功能目录管理办法》等规定,国家市场监督管理总局会同国家卫生健康委员会、国家中医药管理局调整发布了《保健食品原料目录 营养素补充剂(2020年版)》自2021年3月1日起施行。


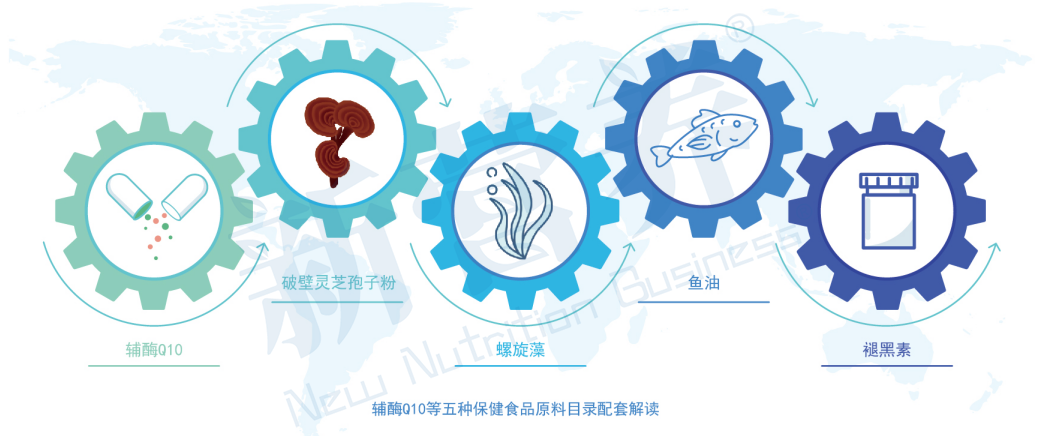
辅酶Q10、破壁灵芝孢子粉、螺旋藻、鱼油、褪黑素
根据《中华人民共和国食品安全法》《保健食品原料目录与保健功能目录管理办法》等规定,国家市场监督管理总局会同国家卫生健康委员会、国家中医药管理局制定了辅酶Q10等五种保健食品原料目录,自2021年3月1日起施行。
根据《中华人民共和国食品安全法》《辅酶Q10等五种保健食品原料目录》,国家市场监督管理总局制定了《辅酶Q10等五种保健食品原料备案产品剂型及技术要求》,自2021年6月1日起施行。
(1)配伍使用的问题
本次列入保健食品原料目录的五种原料是基于原注册的单方产品经研究论证确定的,在产品备案时,仅可单方产品进行备案(其中褪黑素与维生素B6合并开展研究,因此可以单独作为原料,或选用褪黑素+维生素B6做为原料),不可与其他原料复配。维生素C、维生素E作为辅料时其用量应该符合现行《保健食品备案产品可用辅料及其使用规定(2021年版)》。
(2)功能标注问题
辅酶Q10等五种原料在产品备案时,保健功能应当按照原料目录中对应的保健功能进行标注。其中辅酶Q10包括增强免疫力和抗氧化保健功能,允许备案人选择其中一种保健功能进行标注,或者同时标注两个保健功能。此次纳入保健食品原料的保健功能,是基于2003年发布《保健食品检验与技术评价规范》和2009年发布的抗氧化等九个保健食品功能评价方法对应的保健功能声称。如功能声称发生调整,本目录中的保健功能也将相应调整。
(3)原料质量控制
辅酶Q10等五种原料作为批功能性原料,其产品进行备案时,应当按照各原料的技术要求,提供具有合法资质的检验机构出具的原料全项目检验报告。检验报告自签发之日起至在保健食品备案管理信息系统中提交上报备案申请之日止,报告的有效期为2年。检验机构应对原料是否符合现行规定出具结论。产品备案时,原料必须符合《食品安全法》等相关法律法规规定的要求。备案凭证附件2产品技术要求的原料质量要求中,应标明所用原料的来源、供应商、质量标准(其中技术指标要求应符合原料目录中的原料技术要求)等内容。
(4)技术指标选择
根据已批准的辅酶Q10等五种原料单方产品情况,在产品备案时不同原料允许的备案剂型不完全相同,因此各原料在产品备案时应符合所使用剂型的指标要求。此外,参照原料技术要求的技术指标和已批准产品设定的技术指标,配套文件中制定了各产品备案时应该设定的技术指标(包括鉴别、理化指标和标志性成分指标。)
(5)已批准注册产品证书到期转备案
根据《食品安全法》、《保健食品注册与备案管理办法》、《保健食品备案工作指南(试行)》有关规定,原料已纳入保健食品原料目录的产品应当属于备案管理。未来对于原注册人产品转备案时,按照以下原则办理:
1.对于原料为辅酶Q10等五种原料的单方原注册人产品,剂型与可备案剂型一致的,转为备案管理。
2.对于原料为辅酶Q10等五种原料的单方产品,其产品剂型未列入可备案剂型的,原则上应按照备案的产品剂型更改配方后转为备案管理。
3.对于原料为辅酶Q10等五种原料的单方产品,其原料用量未在原料目录中每日用量范围的,建议调整产品用量后转为备案管理。
4.对于原料为辅酶Q10等五种原料的单方产品,其申报或已批准的保健功能不在原料目录的范围内的,对于新申请的产品,严格对保健功能的科学依据进行审评,对于依据十分充足的予以注册;对于再注册的产品,提供上市后人群食用具有保健功能的试验依据,试验依据十分充足的予以再注册,对于予以注册的产品将适时调整该原料的原料目录。如注册申请人同意更改保健功能的,将确认原注册人资质,产品转为备案管理。
04
哪些辅料可以用于备案?
为进一步推进和规范保健食品备案管理工作,根据相关食品安全国家标准及注册产品情况,市场监管总局制修订了配套的《保健食品备案可用辅料及其使用规定(2021年版)》自2021年6月1日起施行。
05
可用于备案的剂型有哪些?
为进一步推进和规范保健食品备案管理工作,根据相关食品安全国家标准及注册产品情况,市场监管总局制修订了配套的《保健食品备案产品剂型及技术要求(2021年版)》,将粉剂、凝胶糖果纳入保健食品备案剂型,自2021年6月1日起施行。
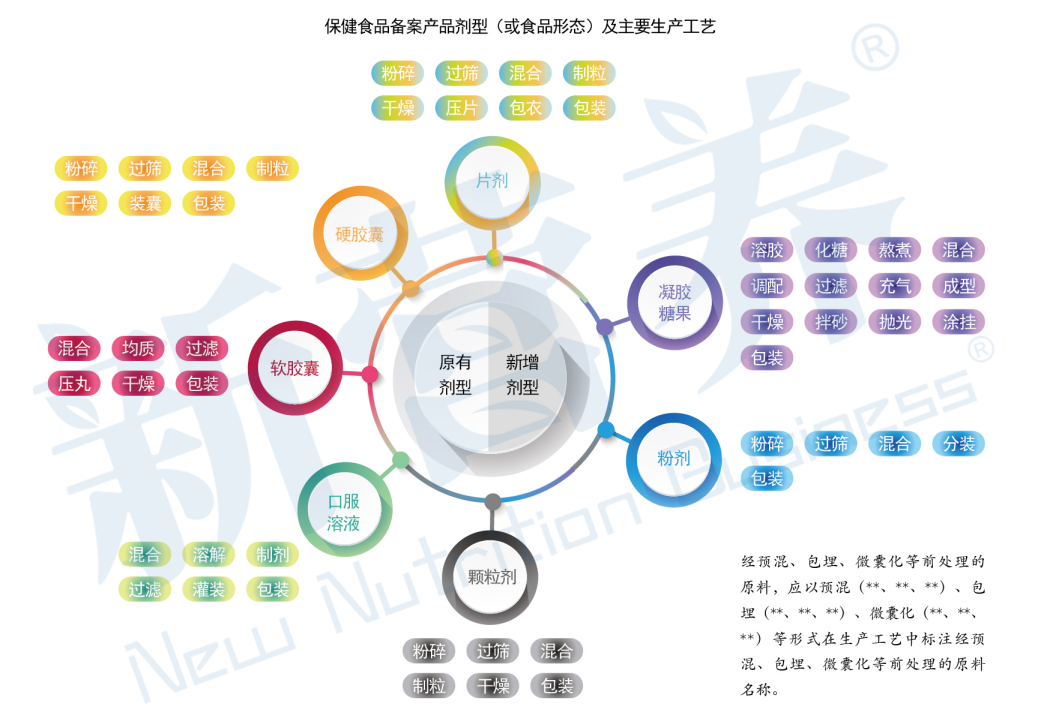
保健食品备案产品剂型及技术要求:
1.补充维生素矿物质产品在备案时可以选用以上剂型(或食品形态)及主要生产工艺。
2.片剂、硬胶囊、软胶囊、口服溶液、颗粒剂为现行《中国药典》中收载的剂型,技术要求中指标设定参考现行《中国药典》和《食品安全国家标准 保健食品》(GB16740)。
3.此次纳入备案的凝胶糖果和粉剂属于食品形态,其技术指标无相应的国家标准,凝胶糖果技术要求和粉剂的保健食品技术要求详见附件。
4.辅酶Q10等五种保健食品原料备案产品剂型及技术要求需符合《辅酶Q10等五种保健食品原料备案产品剂型及技术要求》相关要求。
5.根据保健食品原料目录的陆续发布情况,不同原料可以制备的剂型(或食品形态)以《保健食品原料目录》及其配套文件发布时规定的剂型(或食品形态)为准。
声明:转载此文是出于向母婴行业传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。联系方式:168466559@qq.com



长按扫码 阅读原文


