2024年11月1日,市场监管总局发布《在产在售“无有效期和无产品技术要求”保健食品集中换证审查要点》的公告,自发布之日起施行。
所谓“无有效期和无产品技术要求”的保健食品,就是原卫生部等过去不同时期批准的保健食品其注册证书上“无有效期、无产品技术要求”的批文 ,主要包括全部的“卫食健字”号以及部分于2003-2005年法规过渡期内批准的国食健字产品。
2024年12月9日,保健食品注册管理信息系统的变更注册申请(“双无”换证)模块已完成开发并正式上线运行。
庶正康讯总结了《换证审查要点》中关键性信息,以及企业可能面临的难重点问题汇总如下。

01
换证范围
2023年8月31至2028年8月31日期间在产在售“双无”国产、进口产品。审评机构根据换证需要可以对进口产品开展境外现场核查。
02
换证程序

03
具体要求
申请人主体资质
换证申请人应当为注册人。进口产品的注册人为境外生产厂商。
原注册人为自然人的,提交经公证的产品研发、试制、检验等技术材料所有权转移合同或经公证的注册证书所有权转移合同。
注册转备案
使用保健食品原料目录内原料的,符合备案要求的转备案管理。
换证常见情形以及涉及检测项目
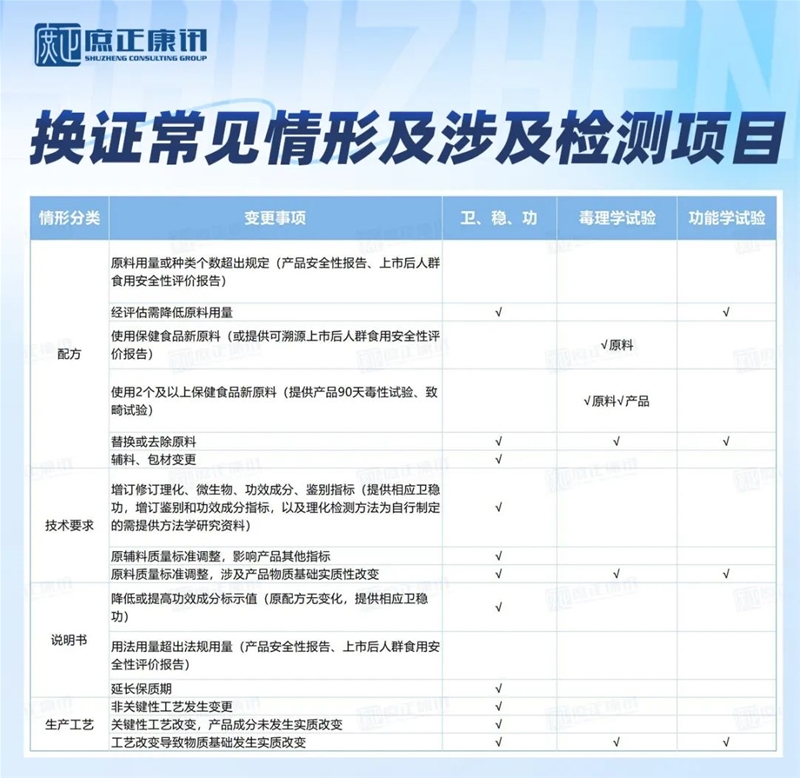
保健食品注册人因自身名称和地址发生变化,产品减少保健功能、更改产品名称、修改标签说明书内容(限删减前言、减少保健功能、减少适宜人群或扩大不适宜人群范围、规范规格表述或注意事项、明确食用方法)的“双无”保健食品变更注册申请,及不涉及保健食品质量安全以及注册证书有效性的,注册人可以单独申请变更,也可以与“双无”换证合并申请。
变更事项为《审查要点》“五、具体要求”中明确应当完善或调整内容的,属于“双无”换证申请必需材料,不应当再单独申请变更。
变更事项不属于《审查要点》“五、具体要求”中明确应当完善或调整内容,完成审评审批后依法应当颁发新的保健食品注册证书、同时注销原保健食品注册证书的(如辅料变更、工艺变更等),建议完成“双无”换证后,再提出变更注册申请。
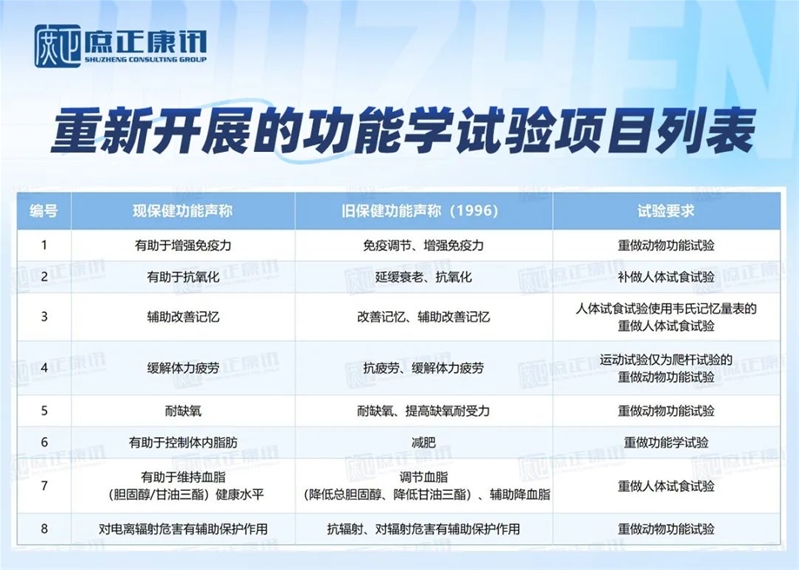
原功能学试验评价依据为原卫生部《保健食品功能学评价程序和检验方法(1996 版)》的,需重新开展的功能学试验项目。
进口保健食品注册人可以按照要求直接提出换证申请,免于提供“省局出具的换证意见”,但还需提供以下资料:
(一)产品生产国(地区)政府主管部门或者法律服务机构出具的注册申请人为上市保健食品境外生产厂商的资质证明文件;
(二)产品生产国(地区)政府主管部门或者法律服务机构出具的保健食品上市销售证明文件;
(三)注册人(境外生产厂商)在我国出入境检验检疫部门的备案或者注册信息和产品进口信息;
(四)产品生产国(地区)或者国际组织与保健食品相关的技术法规或者标准原文;
(五)由境外注册申请人常驻中国代表机构办理注册事务的,应当提交《外国企业常驻中国代表机构登记证》及其复印件;境外注册申请人委托境内的代理机构办理注册事项的,应当提交经过公证的委托书原件以及受委托的代理机构营业执照复印件。
(六)境外销售或进口销售的最小销售包装实样各2个,以及修改后的说明书样稿及修订说明。
声明:转载此文是出于向母婴行业传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。联系方式:168466559@qq.com



长按扫码 阅读原文


