随着老龄化进程的加速、医疗服务供给能力的增强以及消费者健康意识的提高,特医食品的市场需求将持续增长,预计未来几年市场规模有望达到千亿级别。国家对特医食品行业也给予了高度重视,并出台了一系列政策、法律法规来规范行业发展。如2024年11月11日,总局发布了《特殊医学用途配方食品注册临床试验现场核查要点及判定原则》(简称《核查要点》),该新规为特医食品的临床试验管理注入了新的活力,同时也为加速临床急需特医食品的可及性进程提供了坚实的制度保障。
01
逐年注册数量分析
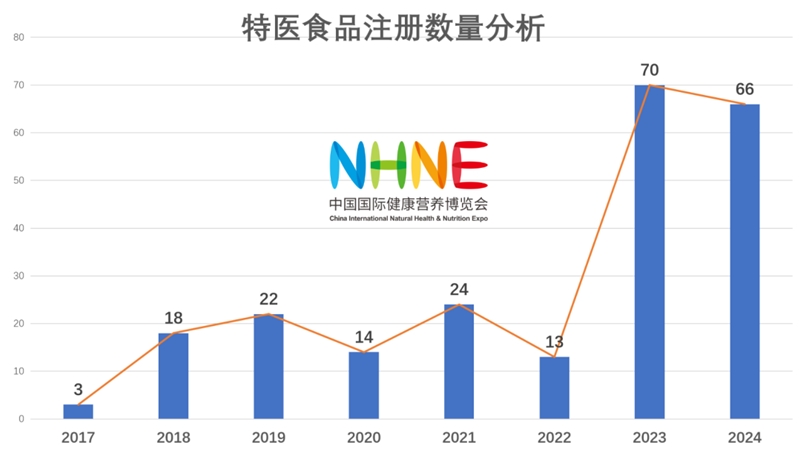
2016年7月1日,随着《特殊医学用途配方食品注册管理办法》正式实施以来,2017年3个,2018年18个,2019年22个,2020年14个,2021年24个,2022年13个,2023年70个,2024年66个。
02
产品类型分析
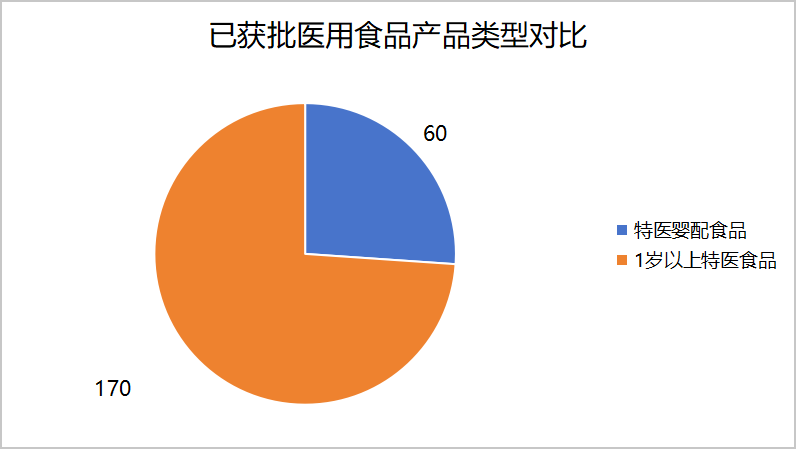
国家市场监督管理总局发布通过注册的特医食品有230款(含已注销),其中特医婴配食品60款,1岁以上特医食品170款,情况对比如下图所示。
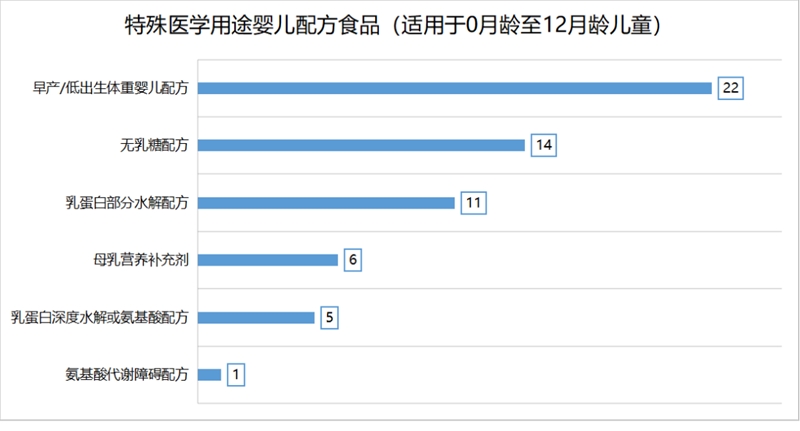
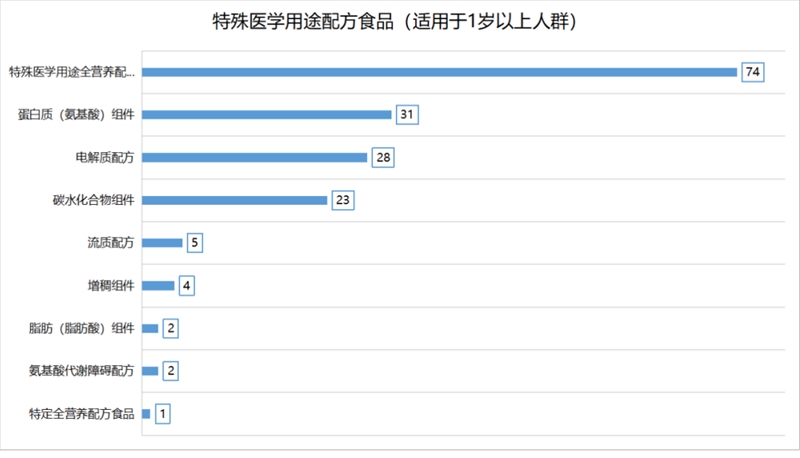
根据现行的GB 29922,已获批的特医食品已覆盖所有的产品类别,每类产品获批数量如下:
03
适用人群分析
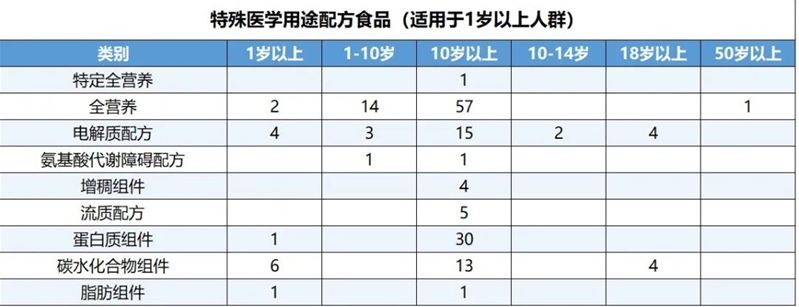
1岁以上人群特医食品适用人群年龄段的分布情况如下表:
04
产品剂型分析
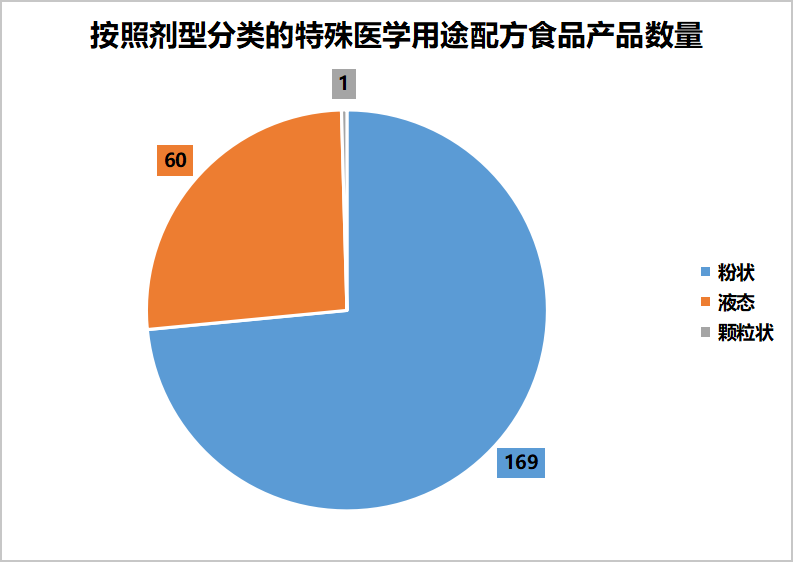
已获批的230款特医食品中粉剂169款,液态60款,颗粒状1款。分布情况如下图:
05
生产企业分析
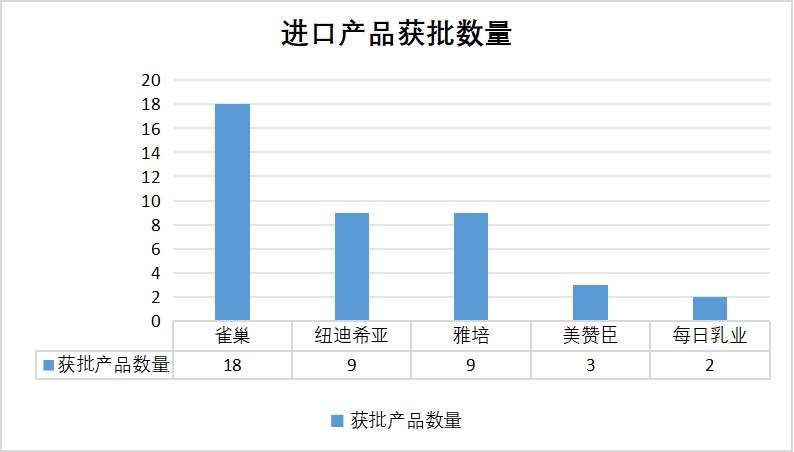
截至目前,共有66家企业获得特医食品注册,国内企业达到61家,国外企业5家。雀巢以18款产品成为在华获批产品数量最多的企业,江苏冬泽位列第二,吉林麦孚列第三。
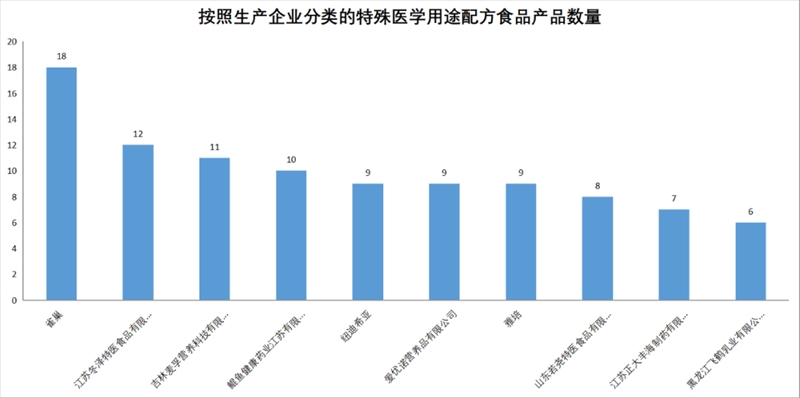
国内产品获批情况
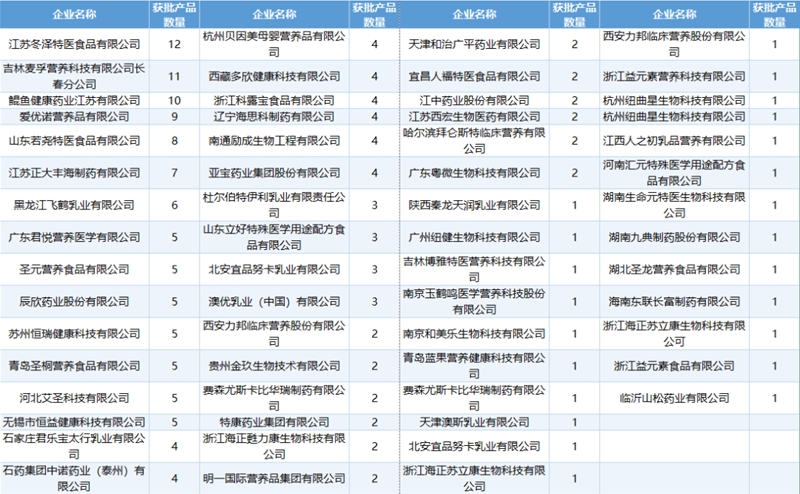
国外企业获批情况
06
特医食品注册清单

声明:转载此文是出于向母婴行业传递更多信息之目的。若有来源标注错误或侵犯了您的合法权益,请作者持权属证明与本网联系,我们将及时更正、删除,谢谢。联系方式:168466559@qq.com



长按扫码 阅读原文


